



2023年4月,瑞思德在《实验室科学》上发表了题为“3D细胞培养在细胞生理学研究中的应用进展”的综述。
研究团队介绍现阶段3D细胞培养方法、优势、现有的支架材料以及在模拟生理学相关进程中的应用,为未来的细胞生理学研究提供参考。
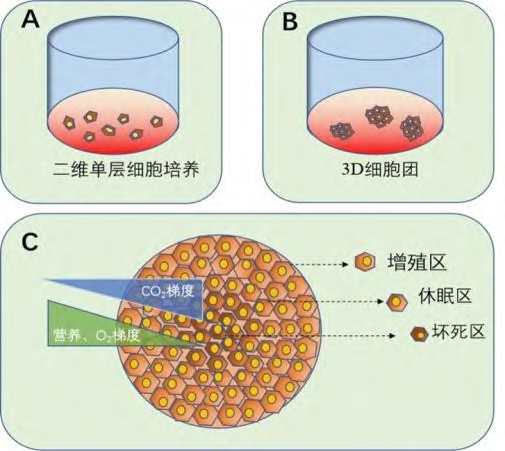
无论生物工程技术,还是生物克隆技术,细胞培养都是一个必不可少的过程。目前大多数的细胞培养都是粘附在二维平面条件下进行的,称为2D细胞培养(见图1A所示)。
培养方法简单
易操作
费用低
1) 细胞团的形成是体内细胞增殖、分化和形成特定功能的一个重要特征
2) 细胞团在形态、相互作用和异质性等方面与体内的组织、器官甚至肿瘤非常相似,能够极大程度地还原体内细胞的真实微环境
3) 细胞团结构更容易描述处于不同阶段的细胞状态,包括增殖、休眠、凋亡、缺氧和坏死等(见图1C所示)
根据有无支架材料,可将3D细胞培养分成无支架的3D培养,和有支架的3D培养。
1944年Johannes Holtfreter在培养胚胎干细胞时发明了悬滴3D培养法。该技术首先将细胞调整到合适的接种密度,然后在平板小孔上方逐滴加入细胞悬液,利用液体表面张力变成悬滴,细胞在重力的作用下聚集到悬滴底部形成微球体。滴入口可用来更换培养基,添加外源胞外基质、生长因子、小分子等(见图2所示)。
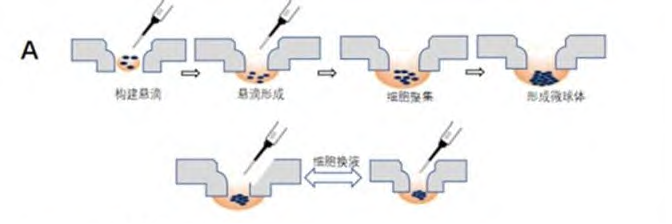
图2 悬滴3D培养示意图
这种方法的优点是每个悬滴所含细胞数相同,细胞团大小一致,数据可重复。然而,由于悬滴的体积受液体表面张力限制,这种方法难以用于细胞大规模培养。
第二种方法是磁悬浮3D组织培养技术。该技术基于噬菌体、磁性氧化铁和金纳米颗粒组成的水凝胶介质进行3D组织培养(见图3所示)。

图3 磁悬浮3D培养示意图
由于噬菌体上表达了配体肽段,能够靶定纳米颗粒,当噬菌体感染细胞时,纳米颗粒被运输到细胞内。一旦细胞装有纳米颗粒,就会对磁力有反应。在培养皿顶部安装磁力环,细胞就可以进行悬浮培养,通过对磁场的空间控制,可以改变细胞群的几何形状,还可以实现不同细胞在共培养过程中的多细胞聚集。
由于磁场所产生的“隐形支架”已经不再是单纯的细胞培养,而让细胞团更像真正的肿瘤,因此,这种3D培养模型适用于探索肿瘤成像、临床治疗和药物开发。
第三种方法是非粘附或超低粘附3D培养,即将不同类型的非粘附涂层包被在培养皿的底部,然后将单细胞悬液接种到其表面进行培养的方式。由于涂层大多具有亲水性、呈非离子的中性等特点,从而抑制细胞通过蛋白质和其他生物分子通过疏水性和离子相互作用被动地粘附(见图4所示)。
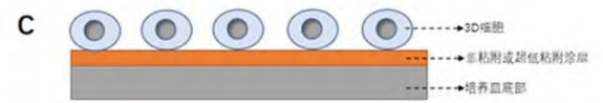
图4 非粘附或超低粘附3D培养示意图
该技术已被广泛用于评估癌细胞的恶性表型和干性潜力,也被用于分离癌症干细胞或肿瘤起始细胞。
支架是3D细胞培养中组织再生的重要组成部分。
1.机械支持作用:支架可以帮助细胞承受外部压力,并为再生的组织提供结构支撑。
2.生物学作用:支架参与了胞外基质的发生和细胞微环境的构成。
3.可渗透性:能够允许营养物质从培养基中转移到细胞或组织,也支持有毒物质和代谢产物从细胞或组织中代谢出去。
支架的选择取决于其功能和细胞类型。由于支架材料具有价格低廉、操作简便以及便于研究细胞和胞外基质相互作用的优势,绝大多数科研人员都使用支架材料对细胞进行3D培养。
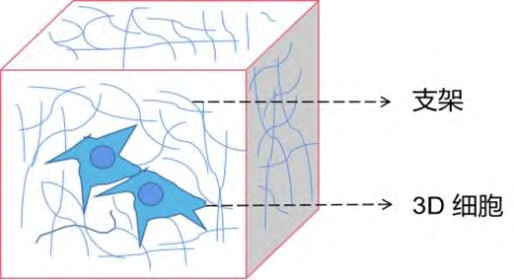
图5有支架的3D细胞培养示意图
天然支架材料来源于动物或人体,其成分、网状结构、生理环境适合细胞的增殖、黏附及新陈代谢,而且抗原性低、无毒性、可降解。
合成支架材料优势:利于进行标准化的生产,具有良好的可塑性。
合成支架材料劣势:亲水性差、对细胞的黏附性较弱,易引发无菌性炎症。
近年来,3D细胞培养技术已被广泛应用于细胞增殖、分化和基因表达水平、细胞信号通路和细胞凋亡机制、细胞集体迁移、细胞外泌体和再生医学等细胞生理学研究中。
近期,一些学者研究了2D和3D培养方法对细胞增殖、分化和基因表达水平的影响。相关数据如下:
1.脂肪来源的间充质干细胞(MSCs)经4天的3D微载体培养后增殖了29.8±3.0倍,而脐带来源的MSCs增殖了5.47±0.93倍。
2.将125mL 3D微载体培养体系扩大至1L,11天后细胞产量可达到1.06×109个;且培养得到的MSCs具有很高的活力和质量,其免疫表型和分化能力不受影响。
3.本课题组在125mL培养体系中,加入10粒多孔微载体,培养4天后,可使脐带MSCs增殖3.6倍,最终收获1.8×107个细胞。这项研究为3D细胞培养实现临床级MSCs生产提供了技术支撑。
4.研究发现3D细胞培养促进了VEGF刺激的脂肪干细胞向内皮样细胞分化。
5.与2D细胞培养相比,3D培养14天的多型胶质母细胞瘤细胞上调了8117个基因表达,下调了3060个基因表达。经分析发现从3D细胞模型能够得到关于多型胶质母细胞瘤更有意义的基因表达信息。
关于细胞信号通路研究同样应用了3D培养技术。有研究人员构建细胞株后用3D培养技术培养细胞,证实了MG53能够通过调节PI3K-AKT信号通路来抑制舌癌的发展进程。
细胞脱离培养平面会导致细胞凋亡,称为失巢凋亡现象(anoikis)。2D培养易导致anoikis,而3D悬浮培养则不会。研究发现,与2D培养的细胞相比,PGE2的增加能够显著抑制3D悬浮培养的细胞外基质复合物(C-MSCs)的细胞凋亡。
细胞集体迁移是指一群细胞通过细胞与细胞通讯、细胞与外环境相互作用而协同运动的过程,在胚胎发育、伤口愈合和癌症转移中起着重要作用。
3D培养技术能够促进细胞彼此之间、细胞与胞外基质之间的相互作用,因此,被广泛用于细胞集体迁移的研究,相关研究如下。
1) 构建了一种新的3D体外模型模拟了胚胎滋养层细胞附着、集体迁移和早期着床的过程。
2) 利用3D细胞培养模型证实了Netrin-1在细胞集体迁移中的表达、作用和机制。
外泌体(exosomes)是指起源于细胞内部的直径40-150nm的细胞外囊泡,由脂质双分子层包围,通过携带的RNA和蛋白质等从而介导细胞通讯。
目前MSCs的2D培养受限于有限的生长空间,一次培养能够分离出的外泌体产量极低,严重阻碍了其在临床前的疗效研究。
人脐带MSCs 2D和3D细胞培养的差异:传统的2D培养细胞密度为20,000个/cm2;基于微载体的3D培养细胞密度达到40,000个/cm2,总产量提高20倍。因此,3D细胞培养技术能够实现MSCs的规模化扩增,为大量富集外泌体提供了新的技术手段,从而有助于细胞外泌体的研究。
MSCs生物学性状难以维持、复制性细胞衰老、自我更新能力降低、旁分泌能力受损等2D培养导致的问题,都可以利用3D技术解决。
3D生物打印,以3D干细胞培养为基础,是一种新型干细胞培养体系,具有仿生功能,它可以产生与目标移植部位相似的功能性细胞、组织或器官。相关研究如下:
1) 利用肝癌细胞和甲基丙烯酰水凝胶的3D打印,构建出肝样微结构。通过评估白蛋白、α1抗胰蛋白酶、转铁蛋白和铜蓝蛋白的产生和释放,发现30天后肝样微结构仍能发挥作用。
2) 将3D培养的人脐静脉内皮细胞作为“生物墨水”,打印出多层次微纤维结构,将这种微纤维结构与iPSC起源的人心肌细胞共培养,能够形成具有自发同步收缩功能的心肌层。
3) 目前3D打印出的气管、膀胱、骨骼和软骨等体内功能良好,临床应用前景可期。
类器官(organoids)是指经体外3D培养所构建出的多细胞团,具有自我更新和自我组织能力,并且可保持来源组织的生理结构和功能特点,是再生医学和个性化医学领域前沿的体外研究模型。3D培养的iPSCs能形成成熟的心脏类器官、功能性肝类器官和脑类器官。
3D 细胞培养技术已从单纯的悬浮成球培养演变到组织工程支架培养、3D打印培养和类器官培养,在细胞生理学研究中的作用越来越重要,在药物发现、疾病模拟、癌症靶向治疗等方面有着巨大的应用前景。
未来的3D细胞培养技术需要医学、生物科学、材料和高分子化学等诸多领域的融入,开发出更好的3D细胞培养技术来模拟体内细胞的真实微环境,更精确地描述体内细胞的生理学进程。